Comité de Bioética de la Investigación
Protocolos y Enmiendas
Previo al sometimiento inicial de cualquier documentación relativa al protocolo de investigación, el investigador principal deberá obtener una serie de avales, como los que aparecen a continuación:
1. Notas y Avales.
- Todo protocolo de investigación presentado debe adjuntar nota o correo electrónico con el registro de RESEGIS del (Ministerio de Salud – Panamá). Realizar el registro a la plataforma RESEGIS (Registro y Seguimiento de Investigación para la Salud), disponible en la página web: https://sisvigplus.minsa.gob.pa/resegis/
- Nota de Sometimiento de los Investigadores Principales
- Nota de Anuencia del Director del Sitio(s) donde se realizará estudio (cuando aplica) (Enlace a Circular de CSS: Circular DENSYPS-SNDTSS-DENADOI-N-7B-2016).
- De requerir una carta de exoneración al pago de las tasas del ICGES, el Investigador deberá dirigir la solicitud al Director General del ICGES y una vez cuente con la aprobación de su solicitud, ésta deberá ser presentada junto a toda la documentación a someter.
2. Documentos en formato Digital.
![]()
En virtud de la política Cero Papel, contenida en la legislación vigente, la información relativa al protocolo, se presentará en formato digital (1 memoria USB) debidamente rotulado con el título del protocolo y versión. Además, el USB contendrá la información siguiente:
- Nota de Presentación dirigida al Presidente del CBI-ICGES
- Declaración de Compromiso del Investigador Principal de adherirse a las buenas prácticas y principios éticos internacionales
- Protocolos (versión en inglés u otro idioma y español), incluyendo anexos y material de soporte.
- Manuales del investigador (“Investigator Brochure”) en el idioma original y en castellano.
- Formularios de reporte de casos (si es necesario).
- Consentimientos Informados
- Asentimiento
- Anuncios dirigidos a posibles participantes
- Documentación destinada a los participantes (Tarjetas, Instructivos y demás).
- Cualquier otro documento que sea necesario para la evaluación integral del protocolo
- Póliza: Contra lesiones o daños producidos como consecuencia de su participación en el estudio (cuando aplique).
Información de los Investigadores
- Declaración del Investigador Principal (Enlace a Declaración del Investigador)
- Hoja de Vida (firmadas y fechadas) de todo el equipo que participará en el estudio.
- Copia de títulos e Idoneidades expedidas por la autoridad o entidad competente.
- Certificaciones de Buenas Prácticas Clínicas con una vigencia mínima de un (1) año de cada uno de los miembros del equipo que participará en el estudio. Dichos Certificados deberán ser actualizados para mantenerlos vigentes durante toda la duración del estudio y deberán corresponder a los aceptados por el CNBI (Comité Nacional de Bioética de la Investigación). Clínicas (Enlace a Nota de CNBI: Circular N°001-CNBI-2019 )De acuerdo a últimas pautas establecidas por el CNBI, los cursos de Buenas Prácticas Clínicas aceptados son: NIH, NIDA y Citi Program. De contar con otro certificado, deberá presentar el temario del curso al CBI que evaluará el protocolo y quedará a discreción del Comité la aceptación del mismo. La validez de los certificados es de 3 (tres) años
- Declaración de Conflicto de Interés de cada uno de los miembros del equipo.
- Compromiso de Adherencia a las buenas prácticas clínicas de cada uno de los miembros del equipo investigador.
Para detalles más específicos sobre el Sometimiento inicial, ver el siguiente vínculo a (Requisitos de Presentación Inicial de Protocolos de Investigación 2022)
3. Documentos en Formato Físico.
![]()
La información requerida se presentará en un (1) sobres de manila de tamaño 13” x 10” que quedará en los archivos del Comité.
El sobre irá rotulado con la información que aparece en el Formulario PT-CBI-ICGES/GEN/002. El sobre contendrá un folder con protectores de hoja transparentes donde irán colocados los documentos que se solicitan a continuación. Se presentarán en formato físico 1 copia en papel de 8 ½” x 11”, teniendo el cuidado de dejar un margen inferior de 4 cm como mínimo, para colocar los sellos de aprobación del Comité los siguientes documentos
que aparecerán a continuación:
A. Carta de Presentación, donde el Investigador Principal solicita la evaluación del Protocolo al Comité de Bioética de la Investigación del Instituto Conmemorativo Gorgas de Estudios de la Salud (CBI-ICGES). Esta carta de presentación debe incluir lo siguiente:
- Resumen del Protocolo (evitar lenguaje técnico)
- Sinopsis o Representación en diagrama de las actividades del protocolo.
- Descripción del proceso a utilizar para la toma de consentimiento informado / asentimiento de los participantes del estudio.
- Diagrama de manejo de eventos adversos serios locales.
B. Consentimiento /Asentimiento. Verificar los siguientes aspectos:
- Que haya una distancia mínima de 4 cm. desde el final de la página hasta la última línea del texto, de manera que el Comité pueda colocar el sello de aprobación del documento, sin que se oculte información importante.
- Colocar una línea en el pie de página de todas las hojas, para que el participante las rubrique con sus iniciales, como constancia de haberlas leído.
- La numeración de las páginas debe ir en formato: pág. ___ de ___.
- Al pie de cada página o en el Encabezado de cada página colocar el Título del Protocolo, Consentimiento Informado o Asentimiento según aplique, con número y fecha de la versión.
- La sección de firmas del participante y del investigador principal y testigo (si aplica) deben ir a continuación del texto del consentimiento informado o de la hoja informativa del participante. Bajo ninguna circunstancia la sección de firmas debe quedar en una página aislada sin relación de continuidad con el resto del formulario de consentimiento informado/asentimiento.
- Debe haber una sección para consultas o dudas de los derechos de los participantes que lleve este modelo: “Si tiene consultas, quejas o dudas sobre sus derechos como participante, puede contactar a las oficinas del Comité de Bioética de la Investigación del Instituto Conmemorativo Gorgas de Estudios de la Salud a los teléfonos: 527-4823, 527-4842, o 527-4989 de Lunes a Viernes de 8:00 a.m. a 3:00 p.m. o al correo electrónico: combioetica@gorgas.gob.pa”
C. Materiales a ser presentados a los participantes. Todo material que haya de ser presentado a consideración de los participantes o posibles participantes, deberá ser sometido para evaluación y aprobación del CBI-ICGES. Estos materiales incluyen todos o algunos de los siguientes::
- Anuncios para enrolamiento
- Panfletos informativos
- Tarjeta para participante
- Cuestionarios/Encuestas
- Diarios
- Formato de Encuesta Telefónica
- Otros
D. Declaración del Investigador: Este documento puede ser llenado directamente de los formularios para Investigadores que aparecen en la página Web, debiendo ser impreso para ser firmado y fechado por el Investigador Principal. (Enlace a Declaración del Investigador).
4. Tasas.
Una vez se haya verificado que la documentación está completa, se procederá a solicitar se realice el pago de las tasas pertinentes, según el cuadro que se encuentra a continuación. (Enlace a Información General Tasas y Servicios)
| DESCRIPCIÓN | TASA USD | OBSERVACIÓN |
| Sometimiento Inicial de Protocolos de Ensayos Clínicos, estudios epidemiológicos o estudios etnográficos | 1,500.00 | Este pago es por protocolo. No se requiere pago adicional si hay varios sitios, siempre y cuando sometan simultáneamente. Protocolos que estén exentos del pago: tesis (estudiantes), Estudios realizados en el ICGES que cuenten con exoneración del pago por la Dirección General del ICGES |
| Sometimiento de sitio adicional | 500.00 | Esta tasa se cobra si no se presentan los sitios de manera simultánea. |
Una vez hecho el pago, se presentará el recibo de pago a las oficinas administrativas del Comité para que se siga el trámite establecido por el Comité para la asignación del protocolo de investigación a los revisores.
ENMIENDAS Y ACTUALIZACIÓN DE CONSENTIMIENTOS
1. Tasas
Según la Resolución de Junta Directiva N° 007 de 9 de septiembre de 2021, en la tabla siguiente se resumen los cobros de tasas relativas al Comité de Bioética de la Investigación. (Tasas y Servicios). Las tasas se cobrarán a estudios y protocolos presentados por grupos institucionales que tengan carácter lucrativo o para instituciones públicas que en alianza con organismos internacionales, reciban presupuesto “grants” y/o subvenciones económicas para la realización de estudios clínicos.
| DESCRIPCIÓN | TASA USD | OBSERVACIÓN |
| Enmiendas + cambios o actualización de Consentimiento Informado | 600.00 | Este pago es por Enmienda al protocolo y aplica a varios sitios, siempre y cuando se sometan de forma simultánea |
| Enmiendas sin consentimiento informado | 500.00 | Este pago es por Enmienda al protocolo y aplica a varios sitios, siempre y cuando se sometan de forma simultánea |
| Actualización de Consentimiento Informado | 100.00/sitio | Este pago es por sitio. |
| Manual del Investigador | 0.00 | No requiere pago alguno. |
| Sometimiento de sitio adicional | 500.00 | Esta tasa se cobra si no se presentan los sitios de manera simultánea. |
| Cambios de tipo administrativos | 0.00 | No se cobrará por cambios de Dirección de los sitios o Introducción o Cambio de Personal del Estudio |
2. Documentos a ser presentados en formato Digital (USB)
![]()
- Nota de Sometimiento de la Enmienda, que debe incluir una explicación de los Cambios realizados al Protocolo y/o Consentimientos/Asentimientos
- Control de cambios en la Enmienda al Protocolo o Consentimientos, de manera que sea fácil visualizar los cambios realizados.
3. Documentos a ser presentados en formato Físico (Papel)
![]()
Se presentarán 1 copias en papel de 8 ½” x 11” con un margen inferior de 4 cm por lo menos, a fin de poder colocar los sellos de aprobación del Comité.
- Nota de Sometimiento de la Enmienda, que debe incluir una explicación de los Cambios realizados al Protocolo y/o Consentimientos/Asentimientos.
- Consentimientos/Asentimientos
- Materiales para los participantes.
Para detalles más específicos sobre el Sometimiento inicial, ver el siguiente vínculo a (Requisitos de Presentación de Enmiendas de Protocolos de Investigación y otros Documentos al Comité de Bioética de la Investigación ICGES 2022)
A partir de marzo de 2018, se iniciará la implementación de la Renovación Anual de los Protocolos de Investigación aprobados por el CBI-ICGES. Esto implica que todos los investigadores principales de protocolos aprobados por el CBI-ICGES deberán enviar una nota dirigida al Presidente del Comité, solicitando la renovación anual. Junto con la nota de solicitud, deberán remitir un informe anual. El período de aprobación de los protocolos será de un año calendario, contado a partir de la fecha en que se emitió la nota de aprobación inicial del protocolo de investigación. Es responsabilidad de cada investigador tener presente la fecha en que se aprobó inicialmente su respectivo protocolo, a fin de cumplir con los términos requeridos para la Renovación Anual.
Procesos
Período de Solicitud
- Para la renovación anual, el Investigador Principal deberá someter una nota de solicitud de renovación anual, junto con el informe anual en un tiempo no mayor de 60 días calendario previo a la expiración y no inferior a 30 días calendario previos a la fecha de expiración, a fin de asegurar un tiempo adecuado para la revisión por el Comité de Bioética.
Vencimiento o Expiración de la Aprobación
- Si la aprobación del protocolo expira antes de que el CBI-ICGES emita la nota de aprobación, el investigador deberá detener todas las actividades de investigación, relacionadas al estudio: no podrá continuar el reclutamiento de sujetos, no podrá hacer uso de los datos recolectados ni procesar muestras.
- Por el bienestar de los pacientes podrá continuarse con el seguimiento de los participantes, pero deberá enviarse una nota al Comité explicando la situación y solicitando autorización para el seguimiento mientras se tramita la renovación. No se procederá al seguimiento de participantes hasta no obtener la aprobación del Comité.
- Aquellos estudios de otra índole diferente a los Ensayos Clínicos, deberán detener inmediatamente cualquier tipo de intervención o de actividad, tales como enrolamientos, encuestas, recolección de datos, revisión de expedientes, procesamiento de muestras, análisis de datos y otros. No podrán reanudar actividades hasta que obtengan la renovación anual de parte del Comité de Bioética.
Cancelación Definitiva del Estudio
- Los investigadores tienen hasta 60 días después de la expiración de la aprobación anual para obtener la aprobación del Comité de Bioética. Transcurridos estos 60 días, el Comité cerrará permanentemente el estudio y un nuevo protocolo, con los gastos que ello implique, deberá ser sometido para revisión del CBI-ICGES.
- Tasas
Según la Resolución de Junta Directiva N° 007 de 9 de septiembre de 2021, en la tabla siguiente se resumen los cobros de tasas relativas al Comité de Bioética de la Investigación. ( Resolución de Junta Directiva de Tasas y Servicios). Las tasas se cobrarán a estudios y protocolos presentados por grupos institucionales que tengan carácter lucrativo o para instituciones públicas que en alianza con organismos internacionales, reciban presupuesto “grants” y/o subvenciones económicas para la realización de estudios clínicos. Es importante aclarar que este pago es por Renovación de Protocolo y no por sitio. Si un protocolo cuenta con más de un sitio de investigación, el primer sitio que envíe el informe realizará el pago. Los demás sitios anexarán una copia del pago en sus informes individuales, de acuerdo con las fechas de aprobación de cada sitio.
| DESCRIPCIÓN | TASA USD | OBSERVACIÓN |
| Renovación Anual | 800.00 | Este pago es por protocolo e incluye a todos los sitios que estén adscritos a un mismo protocolo. |
Exoneración de Pago
Aquellos estudios previamente exonerados del pago inicial, automáticamente serán exonerados del pago de la Renovación Anual y aplican también a estudiantes de grado, maestrías o doctorados, trabajos de graduación de médicos residentes o para instituciones u organizaciones sin fines de lucro o a las que se les haya concedido la exoneración. Igualmente aplica la exoneración para estudios de investigación realizados en el ICGES que cuenten con nota de la Dirección General de exoneración del pago. Puede realizar consulta previamente en caso de dudas.
- Documentos a ser presentados en Formato Físico (3 copias en papel de 8 ½ “ x 11”) y Formato Digital 1 USB.
- Nota de solicitud de la Renovación Anual firmada por el Investigador Principal.
- Informe Anual. Este debe contener la siguiente información:
- Nombre del Estudio y Codificación si tuviera alguna.
- Número de Sitios
- Investigadores Principales de cada sitio.
- Breve descripción del diseño del estudio
- Duración prevista del estudio
- Fecha de aprobación inicial
- Fecha de inicio de la ejecución del estudio.
- Número de participantes tamizados.
- Fallos de tamizaje
- Participantes Enrolados
- Retiros voluntarios de participantes.
- Desviaciones del protocolo y medidas adoptadas durante el último año
- Eventos Adversos Serios locales notificados durante el último año.
- Personal administrativo vigente.
- Cambios administrativos (cambio de dirección, teléfono, de personal administrativo)
- Antecedentes importantes que se observaron durante la ejecución del último año
- Estado Actual del Estudio (en qué fase se encuentran: reclutamiento, tratamiento, seguimiento, análisis de datos, etc.)
- Documentos del estudio que NO han tenido cambio alguno en sus versiones previamente aprobadas.
- Documentos del estudio que SÍ han tenido cambios en las versiones previamente aprobadas.
En los casos de estudios de investigación que no sean ensayos clínicos, el Investigador Principal deberá presentar un informe del estudio, con la información recolectada en el año: muestras recolectadas, análisis de datos, fase en que se encuentran, asuntos administrativos, información que aplique en los puntos anteriormente citados.
1. Reportes de Eventos Adversos Nacionales
El investigador debe presentar:
- 1 (copia) en papel todo reporte inicial, de seguimiento y/o cierre de Eventos Adversos Nacionales.
- Formato de Guía de Eventos Adversos del CBI-ICGES, (Modelo de Nota de Reporte Eventos Adversos)
Además les recordamos la obligación de informar al CBI-ICGES del seguimiento y cierre de cada reporte de Evento Adverso Nacional.
2. Reporte de Eventos Adversos Internacionales o SUSAR´s
El Investigador debe presentar:
- Una (1) copia en papel con la presentación al Comité de Bioética con el listado de Reportes SUSAR´S.
- Un (1) USB con los reportes de SUSAR´S en Español e Inglés (si aplica). (Requisitos de Presentación de Enmiendas de Protocolos de Investigación y otros Documentos al Comité de Bioética de la Investigación ICGES 2022)
3. Desviaciones al Protocolo
El Investigador debe presentar:
- Formato Papel con la Nota de presentación al Comité de Bioética con un cuadro de Desviaciones indicando el Número de sujeto, Descripción de la desviación, comentarios y acción correctiva aplicada para subsanar la desviación.
| N° de sujeto | Desviación | Fecha de la desviación | Comentarios | Acción Correctiva |
1. Reporte Semestral /Anual
Los ensayos Clínicos, estudios con poblaciones vulnerables e investigaciones que incluyen la obtención de muestras biológicas envían reportes de seguimiento como mínimo cada seis (6) meses. Los demás tipos de estudios pueden enviar reportes un informe de seguimiento al menos una vez al año.
El Investigador debe presentar:
- Una (1) copia en papel con la Nota de presentación al Comité de Bioética con un cuadro con la información más relevante del estudio, también incluir la fase en que se encuentra el estudio: reclutamiento o seguimiento. (Requisitos de Presentación de Enmiendas de Protocolos de Investigación y otros Documentos al Comité de Bioética de la Investigación ICGES 2022)
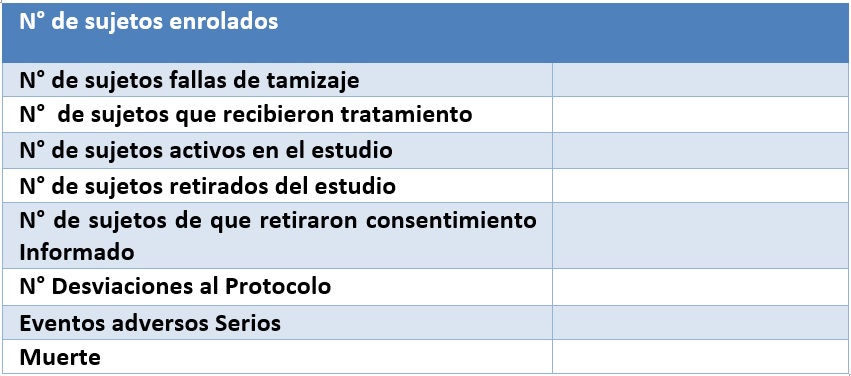
2. Reportes de Cierre de estudios
El Comité de Bioética debe recibir notificación del Investigador Principal al momento de completar el estudio.
En caso de suspensión o terminación prematura del estudio, el Investigador debe notificar al CBI-ICGES, las razones de la terminación anticipada del estudio y deberá entregar un resumen de los resultados obtenidos en el estudio prematuramente suspendido o terminado.
El Investigador debe presentar:
- Una (1) copia en papel con la Nota de presentación al Comité de Bioética indicando las razones de terminación temprana
- Un (1) USB y una (1) copia en papel con el resumen o informe final del estudio una vez esté listo el informe. (Requisitos de Presentación de Enmiendas de Protocolos de Investigación y otros Documentos al Comité de Bioética de la Investigación ICGES 2022)
